生き物におけるあらゆる活動は酵素が触媒する化学反応に基づいています。つまり、酵素は生命と共にあり、 地球という広大な空間で何十億年という長い時間をかけた実験(進化)によって改良し続けられた触媒が酵素です。 そのため、酵素は触媒として優れた性能を持つだけでなく、持続可能性(地球への優しさ)も兼ね備えており、既に医薬品、洗剤、食品加工などに広く利用されています。 酵素は余りにも優れた触媒であるために、これまでは一つの酵素に注目し、研究・利用されることがほとんどでした。 しかし、生体内では複数のタンパク質・酵素が存在し、それらが協働することで複雑な活動を行っているということを考えれば、複数の酵素を組み合わせることによってこそ酵素は真価を発揮するはずです。 また、細胞内では複数のタンパク質・酵素が単に混在しているのではなく、局在化や複合体形成により、それぞれの空間配置は制御されています。 したがって、これまでにない組合せや組立て方でタンパク質・酵素をアセンブルすること、すなわち、『酵素同士の新たな出会い』により、新たな機能の発現や機能の向上が期待できます。 これまで以下のような研究に取り組んできました。
Activities of organisms are generally based on chemical reactions catalyzed by enzymes. Enzymes have been continuously improved in a giant laboratory, the Earth, for billions of years. Enzymes have excellent catalytic properties with sustainability and are now widely used for chemical synthesis, detergents, food processing, etc. Multiple enzymes work synergistically in organisms, indicating that enzymes can demonstrate their potentials in multienzymatic reactions. Furthermore, the spatial arrangement of proteins and enzymes is controlled by localization and complex formation. We have conducted the following studie to achieve new functionalities and improvement of enzymes/proteins by assembling multiple enzymes and proteins in a novel way.
単独では触媒活性を発揮できない酵素も数多く存在し、シトクロムP450もその1つです。シトクロムP450はヘムタンパク質であり、ホルモンや色素、抗生物質などの合成だけでなく、異物(薬物)代謝などに関与しています。シトクロムP450は炭素ー水素結合を直接切断することにより炭素原子を活性化させ、活性化された炭素原子はその周辺環境に応じた反応を起こします。そのため、シトクロムP450が触媒する反応は水酸化、エポキシ化、二重結合形成、脱アルキル化、C-Cカップリングなど非常にバラエティーに富んでいます。
Cytochrome P450s are a superfamily of heme-containing proteins that play important roles in xenobiotic metabolism as well as in the biosynthesis of steroids, flavonoids, and antibiotics. These P450s generate reactive carbon atoms during their catalytic cycle, allowing them to catalyze various reactions, including hydroxylation, epoxidation, C-C coupling, and dealkylation.
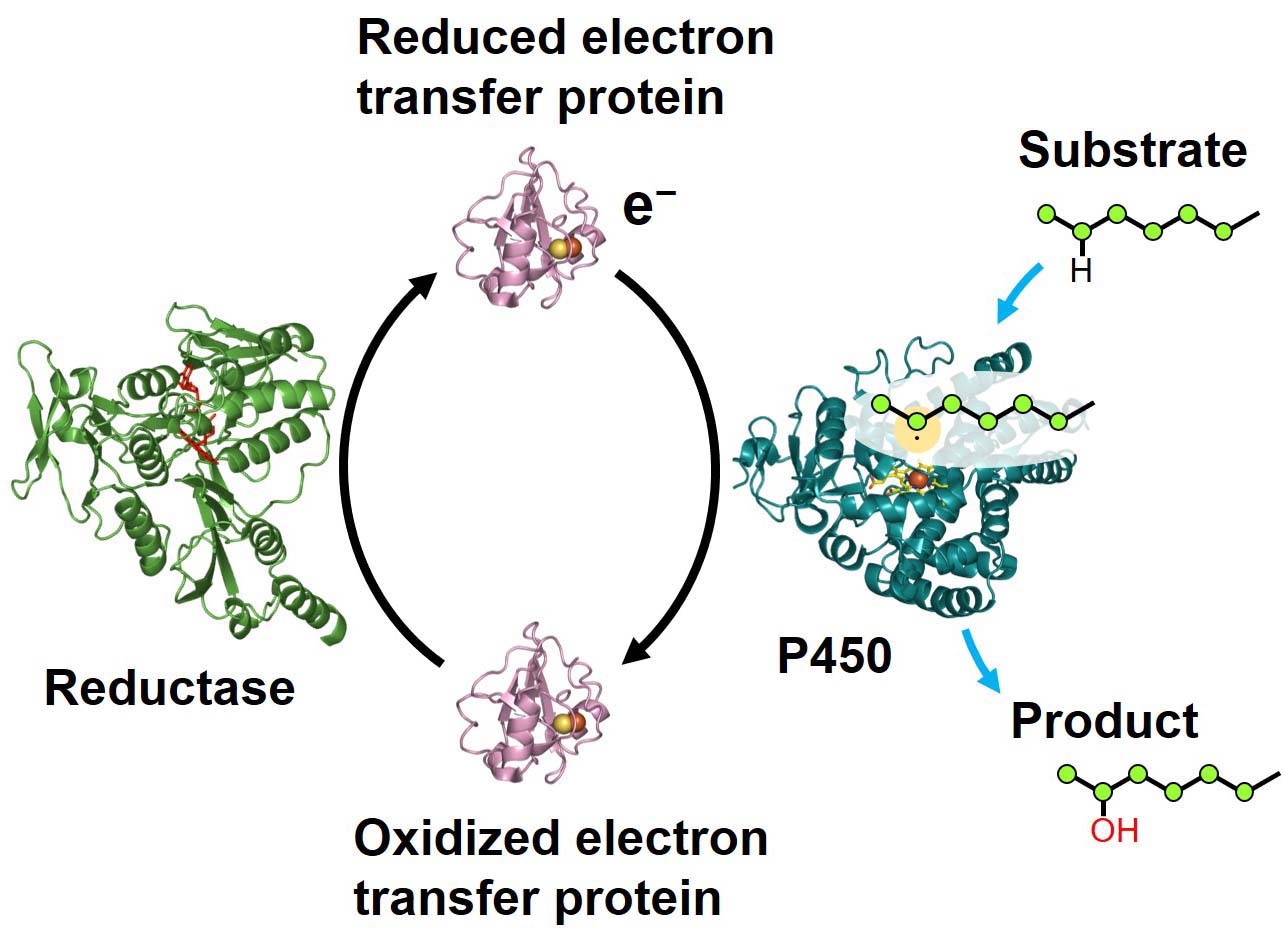
炭素ー水素結合は非常に安定であるため、その切断のためにシトクロムP450は外部からのエネルギー(還元力すなわち電子)を必要とします。電子は水溶液中を飛んで移動することはできないため、酸化還元タンパク質がその運び屋となります。水溶性シトクロムP450のほとんどはフェレドキシンなどの電子伝達タンパク質から電子を受け取り、電子伝達タンパク質自体もその還元酵素から電子を受け取ります。そのため、シトクロムP450と還元酵素の間を行ったり来たりすることになります。
P450s require energy in the form of electrons to cleave the stable C-H bond. Bare electrons cannot move in aqueous solutions, and electrons are generally carried by redox proteins. Most soluble P450s accept electrons from specific electron transfer proteins, which are reduced by their partner reductases. Therefore, electron transfer proteins shuttle between the P450s and the reductases.
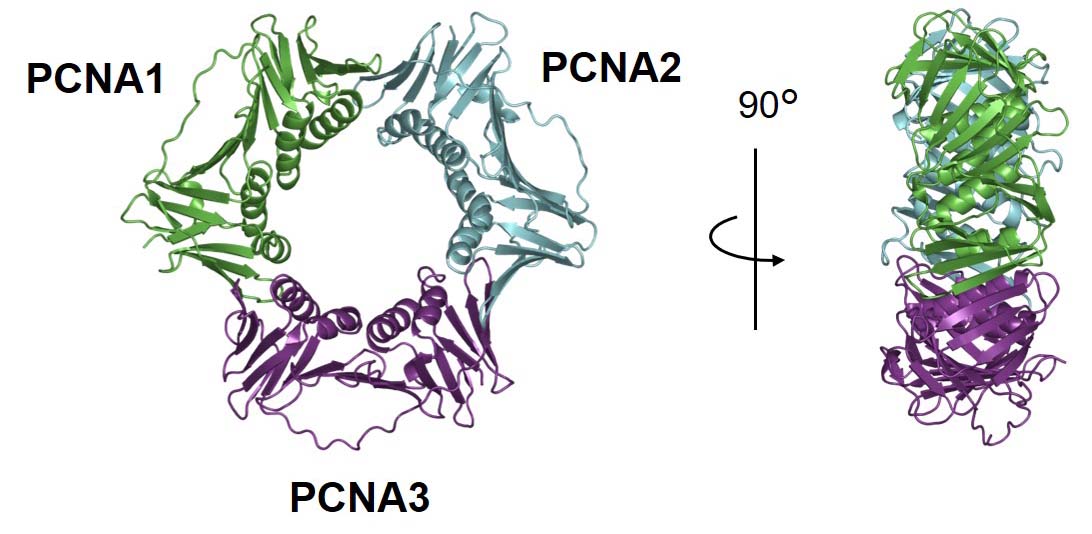
水溶性シトクロムP450、電子伝達タンパク質、還元酵素を人為的に近接させた状態を常に保つことができれば、単独で触媒活性を発揮する(自己充足型)酵素として働くと考えられます。そこで注目したのが、古細菌に由来するヘテロ三量体タンパク質PCNAです。PCNAは異なる3つのサブユニットから構成されており、個別に発現させたサブユニットを混合しても速やかにヘテロ三量体を形成します。したがって、PCNAサブユニットはタンパク質・酵素を選択的に集合させるための連結ユニットとして利用できるのではないかと考えました。
A protein complex, in which a P450s is in close proximity to a specific electron transfer protein and reductase, would work as a self-sufficient enzyme. An archaeal PCNA is a heterotrimeric ring-shaped protein and works as a scaffold for DNA-metabolizing enzymes. The three distinct PCNA subunits can be expressed and purified separately, and form the complete heterotrimeric structure in equimolar mixtures. Therefore, the PCNA subunits can be used as interlocking proteinous bricks to selectively assemble multiple proteins/enzymes.
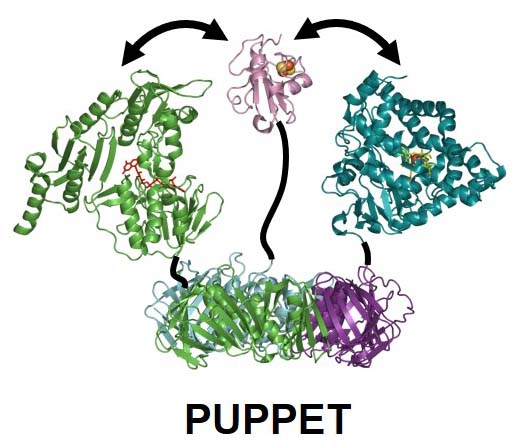
実際、PCNAサブユニットと連結した水溶性シトクロムP450、電子伝達タンパク質、還元酵素は、混合するだけで速やかにヘテロ三量体を形成し、自己充足型酵素として働だけでなく、極めて高い触媒活性を有することも明らかになりました。この自己充足型シトクロムP450をPUPPET(PCNA-utilized protein complex of P450 and electron transfer-related proteins)と名付けました。
Indeed, a P450, an electron transfer protein, and a reductase that are, respectively, fused to the PCNA subunits form an exclusive heterotrimeric complex. The complex, PUPPET (PCNA-utilized protein complex of P450 and electron transfer-related proteins) is a self-sufficient enzyme that does not require auxiliary proteins and exhibits high catalytic activity.
ジスルフィド結合の導入による三量体状態の安定化(第2世代)、リンカーの最適化(第3世代)、複数の電子伝達ユニットの導入(第4世代)により、PUPPETの触媒活性を向上させることにも成功してきました。
Stabilization of the heterotrimeric state by the introduction of disulfide bonds between the PCNA subunits (2nd generation), optimization of the peptide linker connecting the electron transfer protein (3rd generation), and introduction of multiple molecules of the electron transfer protein and the reductase (4th generation) have further improved the catalytic activity of the PUPPET.
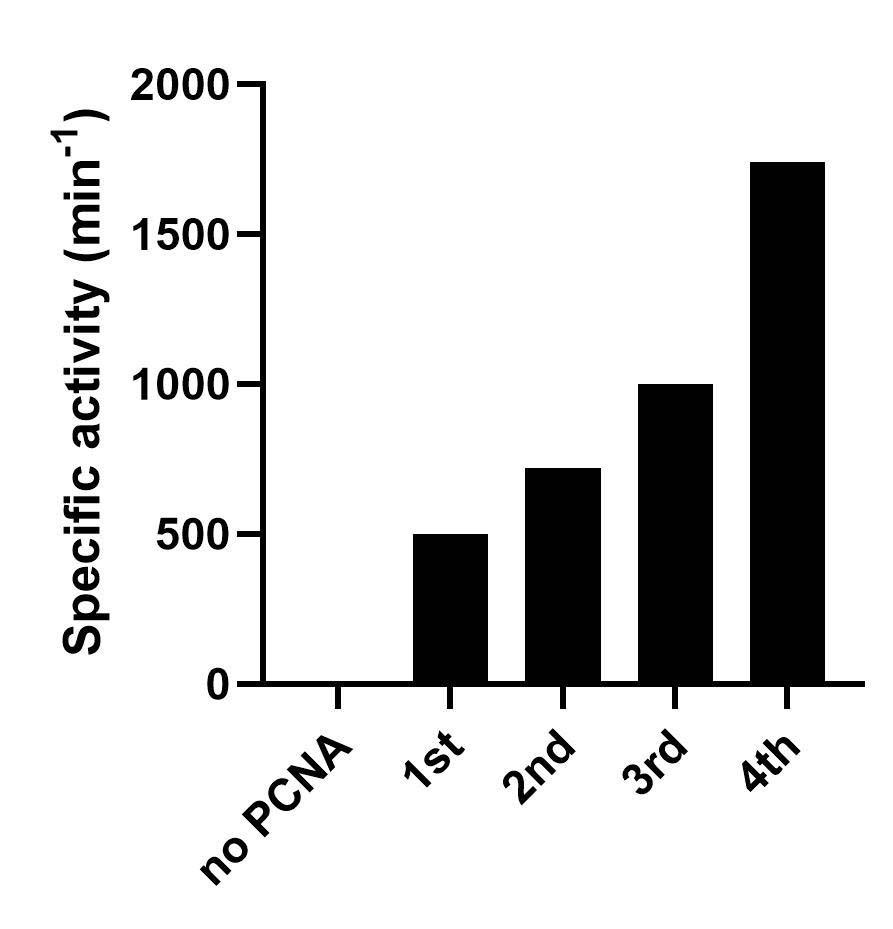
この技術を発展させることにより、これまでほぼ不可能であった水溶性シトクロムP450の固定化も実現しています。また、この集合化技術をセルロース分解酵素系に応用することで、酵素の空間配置や結合様式が分解活性に与える影響を明らかにしました。このようにタンパク質・酵素をナノサイズのブロックとして用い、構造体を組み立てることにより、機能の増強やこれまで不可能とされてきたことの実現を目指して研究を進めています。
Furthermore, this assembly strategy was applied to cellulase systems, revealing how enzyme spatial arrangement and binding mode influence degradation efficiency. We aim to handle proteins/enzymes as nano-scale bricks, selectively assembling multiple proteins/enzymes to enhance functions of proteins/enzymes and generate new functionalities.

黄色ブドウ球菌由来ペプチド転移酵素Sortase Aは細胞壁にタンパク質を提示する役割を担っています。実際の触媒反応としては、タンパク質のC末端側に位置するLeu-Pro-Xaa-Thr-Gly配列中のスレオニンーグリシン間のペプチド結合を切断した後、オリゴグリシンとの間でペプチド結合を再形成させます。Leu-Pro-Xaa-Thr-Gly配列を付加したターゲットタンパク質・ペプチドに対して特異的にタンパク質やペプチド、合成分子を水溶液中で連結することができます。そのため、細胞表層タンパク質の標識やタンパク質・ペプチドの環状化、タンパク質の脂質修飾などに利用されています。
A Staphylococcus aureus transpeptidase, sortase A, plays a key role in anchoring cell surface proteins to the cell wall. This enzyme recognizes the LPXTG sequences located at the C-terminal region of its target proteins. Following the cleavage of the peptide motif between Thr and Gly, sortase A then establishes a new peptide bond between Thr and an N-terminal oligoglycine. Proteins/peptides of interest containing an LPXTG sequence can be specifically linked to proteins, peptides, and synthetic molecules in water. Now, sortase A is a powerful tool for cell surface labeling, cyclization of proteins and peptides, and lipid modification of proteins.
しかし、Sortase Aによる反応は完全な可逆反応であるため、反応収率が100%となることはありません。酵素は触媒として働くので、酵素の改良を行っても、平衡の移動は不可能であり、反応収率を上げることはできません。
However, the sortase A-catalyzed transpeptidation reaction is completely reversible, and therefore the reaction yield never reaches 100%. Protein engineering of sortase A cannot address this limitation because enzymes do not shift chemical equilibrium.
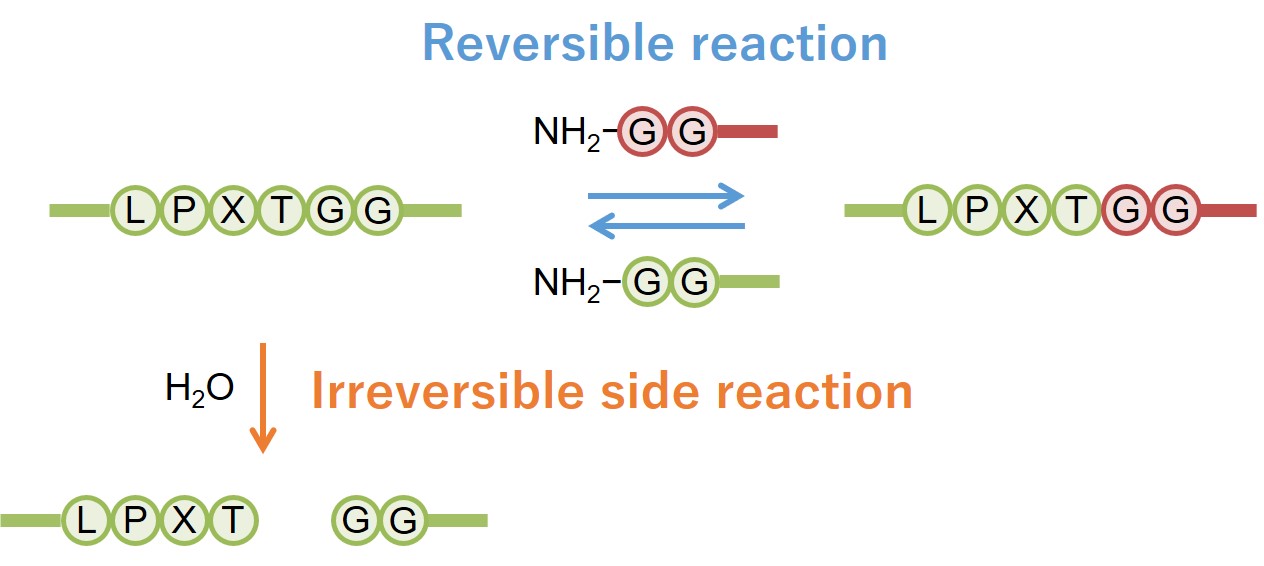
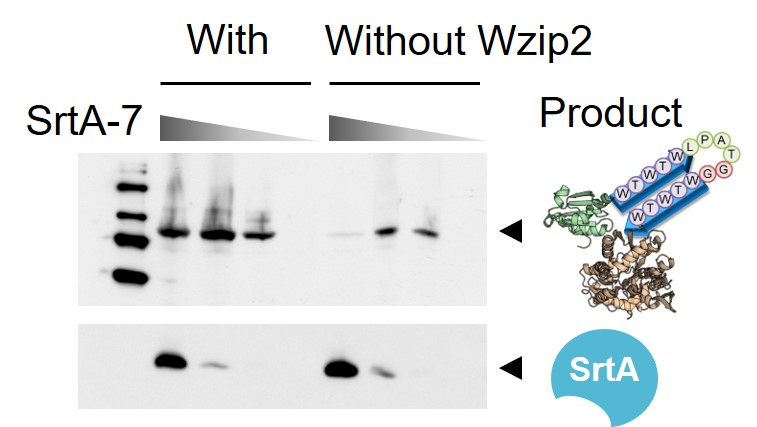
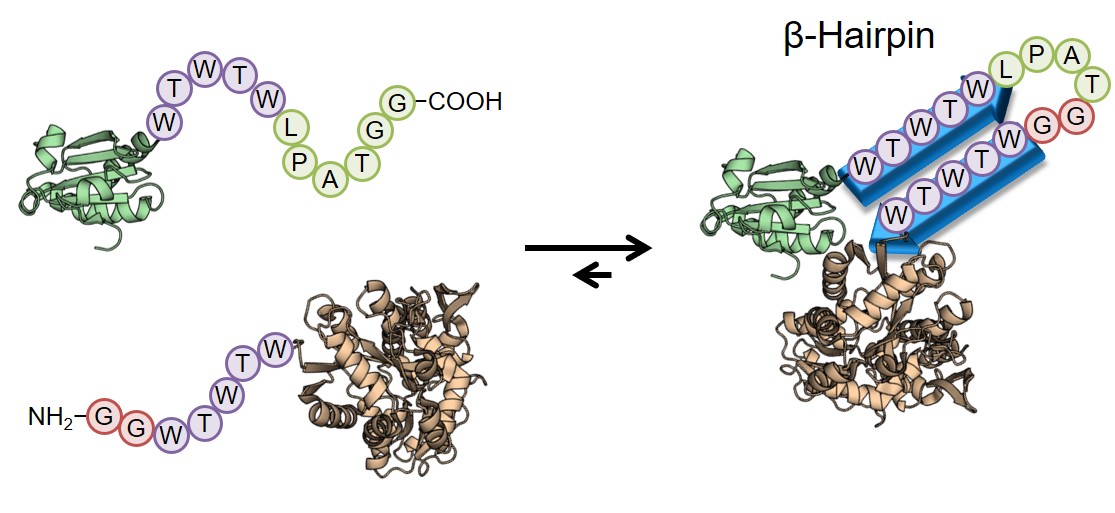
ペプチドが基質として酵素に認識される場合、触媒ポケットの形にフィットするようコンフォメーションが変化します。逆に言えば、ペプチドであっても特定のコンフォメーションを保ち続けることができれば、酵素には認識されないことになります。実際、付加配列により生成物が安定な2次構造を形成できるようにすると、逆反応だけでなく副反応も抑制し、反応収率は大きく向上しました。
We hypothesized that the formation of a rigid structure around the LPXTG sequence would protect the product from the reverse reaction. In fact, additional peptide sequences around the recognition sequence induced a stable secondary structure, resulting in an improved reaction yield.
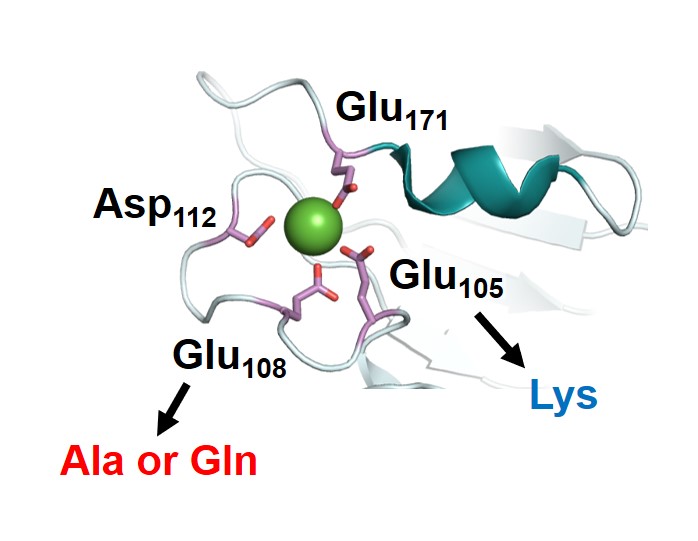
Sortase Aには触媒活性がCa2+依存性を示すという特徴もあります。Ca2+はペプチド転移反応には直接関わらないものの、基質結合部位の構造の安定化に寄与するため、Ca2+非存在下では基質を捕まえることができず、その結果、反応を触媒できません。そこで、Ca2+と結合するアミノ酸残基を置換することにより、Ca2+依存性非依存性を付与することに成功しました。
Ca2+ is essential for the sortase A-catalyzed reaction, which has limited applications in sortase A-mediated protein/peptide modification. It stabilizes the conformation of the substrate binding site and is not directly involved in the catalysis. Amino acid substitutions at the Ca2+ binding site can stabilize the substrate binding site in the absence of Ca2+, resulting in sortase A enzymes that are active without of Ca2+.
そして、さらに改良を加えたSortase A変異体はCa2+濃度が極めて低い細胞内でもタンパク質連結反応を行うことができました。さらに、上で紹介した反応収率向上法と組み合わせることで細胞内でも反応も十分に行えることを明らかにしています。
A further improved sortase A mutant catalyzes a protein ligation reaction in E. coli, where Ca2+ concentration is very low and the wild type does not function. Combination with the secondary structure formation of the product sufficiently increases the yield of the ligation product in E. coli.