小分子が媒介する共役酵素反応において、酵素を分子レベルで近接させることにより近接化効果が生じることを期待して行った研究です。しかし、結論としては、水溶媒中に2分子の酵素を単に近づけただけでは大した効果は得られないということが分かりました。
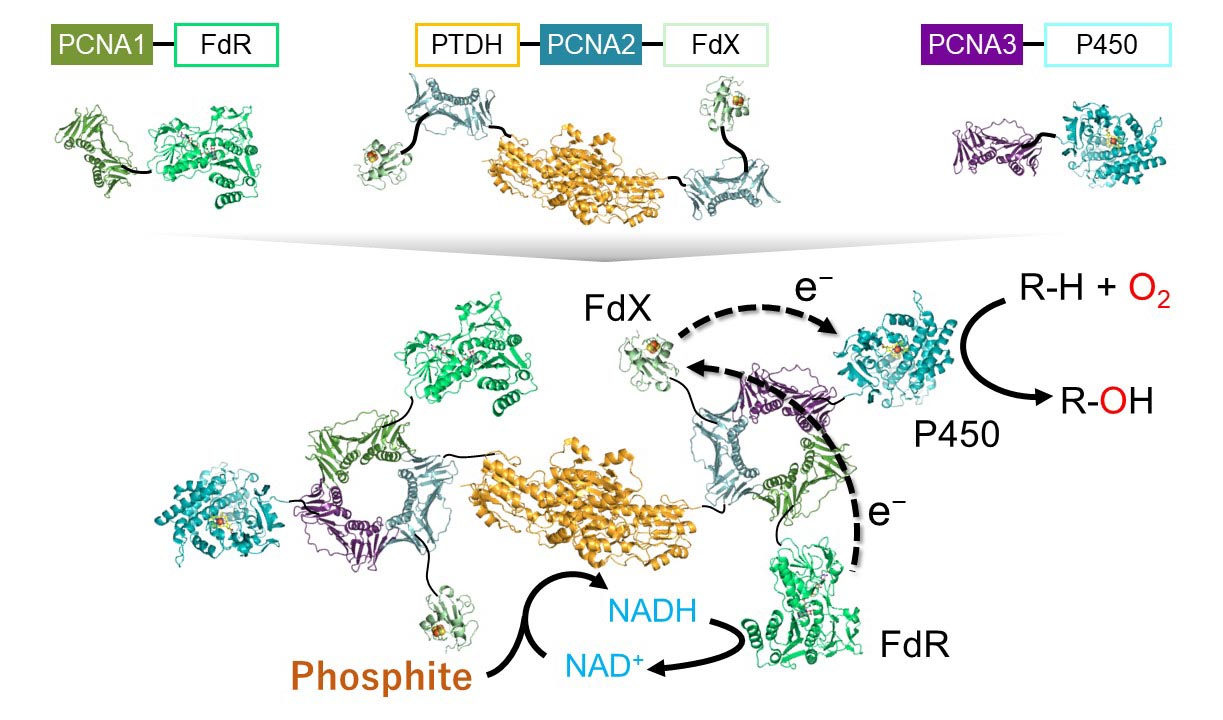
クラスIに属するシトクロムP450は、NAD(P)Hによって2電子還元されたフェレドキシン還元酵素からフェレドキシンを介して1電子ずつ電子を受け取ります。つまり、フェレドキシン還元酵素によってNAD(P)HからNAD(P)+へと酸化されます。亜リン酸脱水素酵素は亜リン酸のリン酸への酸化反応においてNAD(P)+をNAD(P)Hへと還元することができ、補酵素再生用酵素として注目されているます。亜リン酸脱水素酵素をフェレドキシン還元酵素近傍に位置させることにより、フェレドキシン還元酵素での反応によって生じるNAD+は溶媒中に拡散する前に亜リン酸脱水素酵素に到達し、亜リン酸脱水素酵素によって生じるNADHは溶媒中に拡散する前にフェレドキシン還元酵素に到達するという現象が生じるかもしれません。このような現象が起きれば、補酵素の局所濃度が上昇する、すなわち、見かけの補酵素濃度が上昇するため、補酵素量を減らすことができます。そこで、P450、フェレドキシン、フェレドキシン還元酵素からなるタンパク質複合体に補酵素再生用酵素を導入し、フェレドキシン還元酵素の近傍に補酵素再生用酵素を近接させた場合の効果について調べました。
よく考えてみれば当たり前のことですが、そのような効果はほとんど見られませんでした(ごくわずかにはあるかもしれない)。水分子と結合している水溶性補酵素は酵素と結合した状態では水とは結合していません。つまり、酵素と結合する際には脱水和、酵素から解離する際は水和することになります。補酵素の拡散速度が水和・脱水和の速度と比べて十分に遅い状況にならない限りは近接化効果は見られないということです。
Proximity effect is expected to be appeared when two enzymes are adjacent to each other in bi-enzyme systems. However, this study revealed that proximity arrangement of two enzymes in dilute solution does not provide a
significant advantage on the mass transfer of a product by the first enzyme to the second enzyme.
Class I P450s accept electrons from specific ferredoxins, which are reduced by specific ferredoxin reductases in the presence of
NAD(P)H. Namely, NAD(P)H is oxidized to NAD(P)+ by ferredoxin reductases in the P450-catalyzed reaction system. Phosphite dehydrogenase (PTDH) is an attractive enzyme because the enzyme almost irreversibly converts
NAD(P)+ to NAD(P)H in the presence of phosphite. PTDH located close to the ferredoxin reductase may catch NAD+ that is generated by the ferredoxin reductase before diffusion to bulk water. The ferredoxin reductase
also may catch NADH directly from PTDH. To examine the effect of the close placement, PTDH was incorporated into an artificial heterotrimeric complex of Pseudomonas putida P450, putidaredoxin and
putidaredoxin reductase. The protein complex catalyzed d-camphor hydroxylation in the presence of phosphite, indicating NADH regeneration by PTDH. However, the NADH regeneration was not significantly enhanced by the close placement.
Water-soluble cofactors bind to water molecules in aqueous solution but is dehydrated when binding to enzymes. The dehydration and dehydration processes, namely, the cofactor binding and release processes need to be much faster than the
diffusion of the cofactors to achieve the proximity effect. The binding of the cofactor to PTDH and putidaredoxin and the release from the enzymes would not be fast.
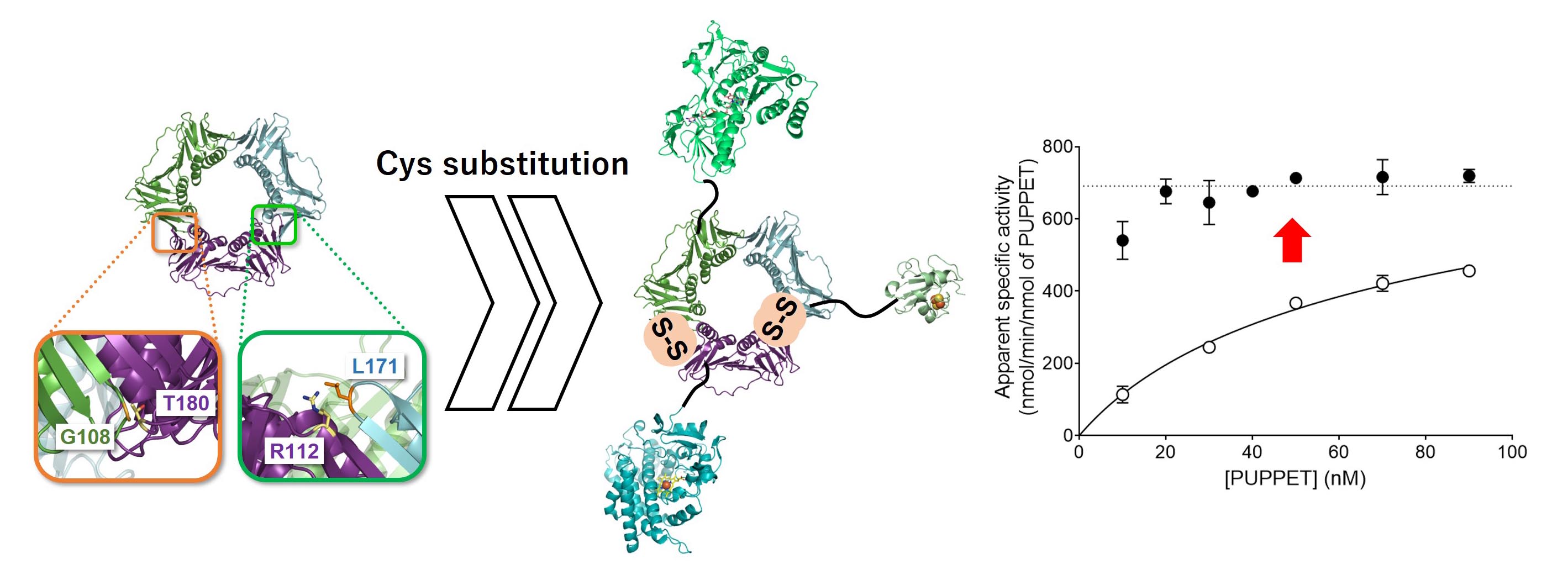
Sulofolobu solfataricus 由来PCNAヘテロ三量体タンパク質を利用したタンパク質の集合化は、発現させたタンパク質を混合するだけでよいため、非常に簡便です。しかし、非共有結合的に集合化させているため、低濃度では解離してしまうという問題がありました。先行研究(ChemBioChem, 11, 2010,
1517-1520)では、PCNAを利用してシトクロムP450、電子伝達タンパク質、還元酵素を集合化させると、高い触媒活性を発揮させることが分かりました。しかし、タンパク質濃度を高くすると、反応速度が速すぎて測定できないという問題があったため、実際には部分的に集合体が解離した状態で測定しており、真の触媒活性は不明でした。
Sulofolobu solfataricus
由来PCNAはシステイン残基を含まないため、サブユニット間のインターフェース近傍に位置するアミノ酸残基をシステイン置換すると、サブユニット間にジスルフィド結合(共有結合)を形成させることができ、ヘテロ三量体状態を安定化させることに成功しました。ヘテロ三量体状態の安定化により、先行研究では、やはり真の触媒活性は測定できていないことが明らかとなりました。また、タンパク質複合体において人為的に分子間ジスルフィド結合を導入するという研究はそれまで行われていませんでしたが、天然に存在するジスルフィド結合と同様にα炭素間が5.5Å程度となるアミノ酸残基をシステイン置換の対象とすればよいことも明らかとなりました。
The heterotrimeric PCNA protein from Sulofolobu solfataricus is an easy-to-use tool to assemble multiple proteins because selective protein complexes are obtained by simply mixing proteins
fused to the PCNA subunits. However, an advantage of the specific non-covalent complex formation is inextricably associated with the disadvantage of its concentration-dependent dissociation. We previously demonstrated that a bacterial
cytochrome P450 and its two redox partner proteins are spontaneously form a protein complex by fusion to the PCNA subunits and work as a self-sufficient enzyme with a high catalytic activity. The high catalytic activity makes it difficult
to follow the initial change of the reaction accurately. Thus, the observed catalytic activity was underestimated.
Selective disulfide bonds were introduced between the subunits at the interfaces of the PCNA heterotrimer by cysteine substitution because the PCNA has no cysteine residue. The covalent bond formation stabilized the heterotrimeric state
of the protein complex composed of the P450 and its redox partner proteins, and revealed its true catalytic activity. This study also revealed that amino acid residues whose alpha carbons are about 5.5 Å away from each other are
candidates for the cysteine substitution to generate a disulfide bond.
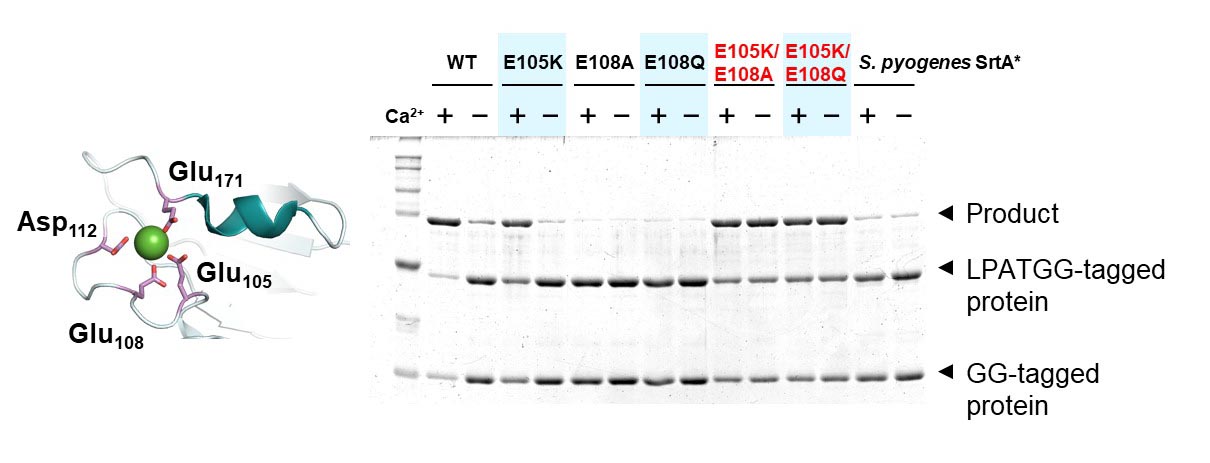
黄色ブドウ球菌由来sortase
Aはタンパク質の翻訳後修飾のツールとして有用です。しかし、その触媒活性はCa2+依存性を示すため、小胞体以外のCa2+濃度が低い細胞内環境やリン酸イオンなどのCa2+と強く結合する化合物の存在下では十分な触媒活性を発揮できないという問題がありました。
Ca2+は触媒反応に直接関わっているのではなく、基質が結合した時のコンフォメーションを安定化させる役割を担っているため、Ca2+が結合しなくてもコンフォメーションが安定化させることができるような変異導入によりCa2+非依存性sortase
Aを取得できると考えました。連鎖球菌や炭疽菌に由来するsortase AはCa2+非要求性であるため、これらのアミノ酸配列と比較することにより変異導入するアミノ酸残基を決定しました。E105K/E108A変異およびE105K/E108Q変異は黄色ブドウ球菌由来sortase
AにCa2+非依存的触媒活性を付与することが明らかとなりました。E105KやE108A(Q)の単独の変異ではCa2+非依存的触媒活性を獲得できないことは非常に面白い点であり、一か所ずつ調べるというアプローチは適切であるとは限らないということが分かります。なお、この論文は掲載号のSpotlightsに選ばれています。
The catalytic activity of Staphylococcus aureus sortase A (SaSrtA) is dependent on Ca2+, because binding of Ca2+ to Glu residues distal to the active site stabilizes the substrate binding site. This Ca2+-dependency restricts the situations where SaSrtA is used as a protein modification tool. Here, we obtained Ca2+‐independent SaSrtA by substituting two Glu residues, Glu105 and Glu108, in the Ca2+‐binding pocket. Although single mutations decreased SaSrtA activity, mutations of both Glu105 and Glu108 resulted in Ca2+‐independent activity. Kinetic analysis suggested that the double mutations affect the substrate binding site, without affecting substrate specificity. This approach will allow us to develop SaSrtA variants suitable for various applications, including in vivo site‐specific protein modification and labeling. This article is selected as a spotlight article.
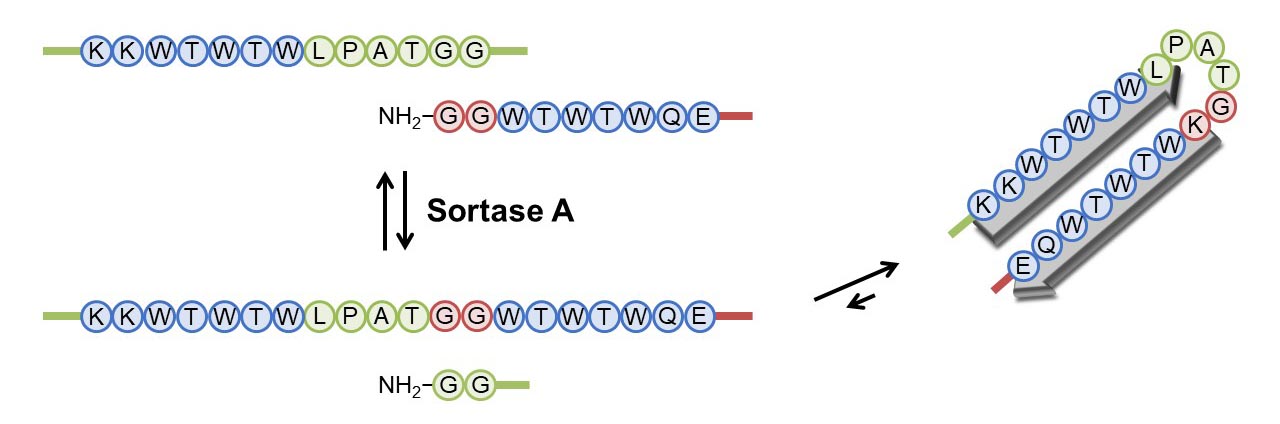
黄色ブドウ球菌由来sortase Aはペプチド転移酵素であり、Leu-Pro-Xaa-Thr-Gly配列のThr-Gly間を切断し、ThrとオリゴグリシンのN末端(一級アミン)との間にペプチド結合を形成する反応を触媒します。N末端のアンカー配列を削ったsortase Aは水溶性が高く、Leu-Pro-Xaa-Thr-Gly配列の認識は厳密であるため、翻訳後のタンパク質を改変(機能付加)するツールとして利用されています。しかし、実際にsortase
Aを融合タンパク質を作製するために利用したところ、その生成収率は高いものではありませんでした。Leu-Pro-Xaa-Thr-Gly配列とN末端オリゴグリシン間のペプチド連結反応は完全な可逆反応である上に、副反応としてThr-Gly間の加水分解反応も触媒するためです。
酵素反応において重要なことは、基質が酵素に結合した際に、活性中心に対して基質が適切に空間配置されることです。これにより、高い比活性だけでなく、反応の立体特異性・位置特異性を実現しています。したがって、Leu-Pro-Xaa-Thr-Gly基質はsorase
Aに結合する際は特定のコンフォメーションをとるはずであり、過去の研究においてもそのことは報告されていました。そこで、生成配列が安定な2次構造をとることができれば、逆反応を防げるのではないかと考えました。
トリプトファンジッパーは安定なβ-ヘアピンを形成することが知られており、そのループ配列Asn-Pro-Ala-Thr-Glyの前後にTrp-Thr-Trp配列を持ちます。ループ配列がsortase Aの認識配列に類似していることから、sortase
Aの基質配列に置換してもβ-ヘアピン構造をとることができるのではと予想しました。実際には、トリプトファンジッパーのループ配列をsortase Aの認識配列に置換するとβ-ヘアピン構造の安定性は低下したため、Trp-Thrペアを一つ追加しました。連結反応後に生成する配列でのみβ-ヘアピン構造をとるため、逆反応を抑制するだけでなく、生成物の加水分解反応を抑えることができ、大幅に生成収率の向上させることに成功しました。
A Staphylococcus aureus transpeptidase, sortase A (SrtA), cleave the peptide bond between Thr and Glyu in Leu-Pro-Xaa-Thr-Gly sequence and connects an N-terminal oligoglycine to the C-terminus
of Thr. Because of strict recognition of the Leu-Pro-Xaa-Thr-Gly sequence, SrtA is used as a tool for post-translational protein modification. However, the reaction yield was low when SrtA was used to prepare fusion proteins from two
separate proteins. The protein ligations do not proceed to completion due to their reversibility.
We hypothesized that rigid structure formation around the recognition sequence after the ligation reaction could prevent the reverse reaction. The Leu-Pro-Xaa-Thr-Gly substrate is known to form an “L-shaped” structure on a large groove of
SrtA, suggesting that Leu-Pro-Xaa-Thr-Gly sequence in a secondary structure may not be recognized by SrtA. Tryptone zippers are β-hairpin peptides in which Thp-Thr-Trp pairs are located at the zipper position. The loop sequence,
Asn-Pro-Ala-Thr-Gly, is similar to the SrtA recognition sequence, suggesting that β-hairpin peptides containing the SrtA recognition sequence can be designed. In fact, our designed peptide formed a stable β-hairpin structure and is a
tolerant to digestion by SrtA. Thus, introduction of the tryptone zipper-derived sequence around the SrtA recognition motif dramatically increased the reaction yield of protein ligation.
細菌由来シトクロムP450の多くは触媒活性を発揮するために、電子伝達タンパク質とその還元酵素を必要とします。ただ、天然には例外的にシトクロムP450と電子伝達タンパク質、還元酵素が遺伝子上で連結した融合タンパク質も存在します。
Bacillus megaterium 由来P450BM3は有名な天然の融合型P450であり、単独で触媒活性を発揮するため、扱いやすく、良い研究対象とされてきました(活性も高い)。
そのため、本来、個別に存在するシトクロムP450、電子伝達タンパク質、還元酵素であっても、人為的に連結させることによって、単独で高い触媒活性を発揮する酵素へと変換できるのではないかと考えられてきました。
しかし、その多くの試みは成功したとは言えるものではありませんでした。P450BM3はホモ二量体型の酵素であり、電子伝達が1つのポリペプチド鎖上で行われているわけではなく、実際に起きているのはホモ二量体内での分子間電子伝達です。
既に分岐型構造を有する融合P450の研究(Protein Eng. Des. Sel., 11, 2010, 1517-1520)から、シトクロムP450、電子伝達タンパク質、還元酵素それぞれに1本のリンカーを付けて集合させれば、分子内電子伝達により活性を発揮する自己充足型酵素へと変換できることが分かっていました。
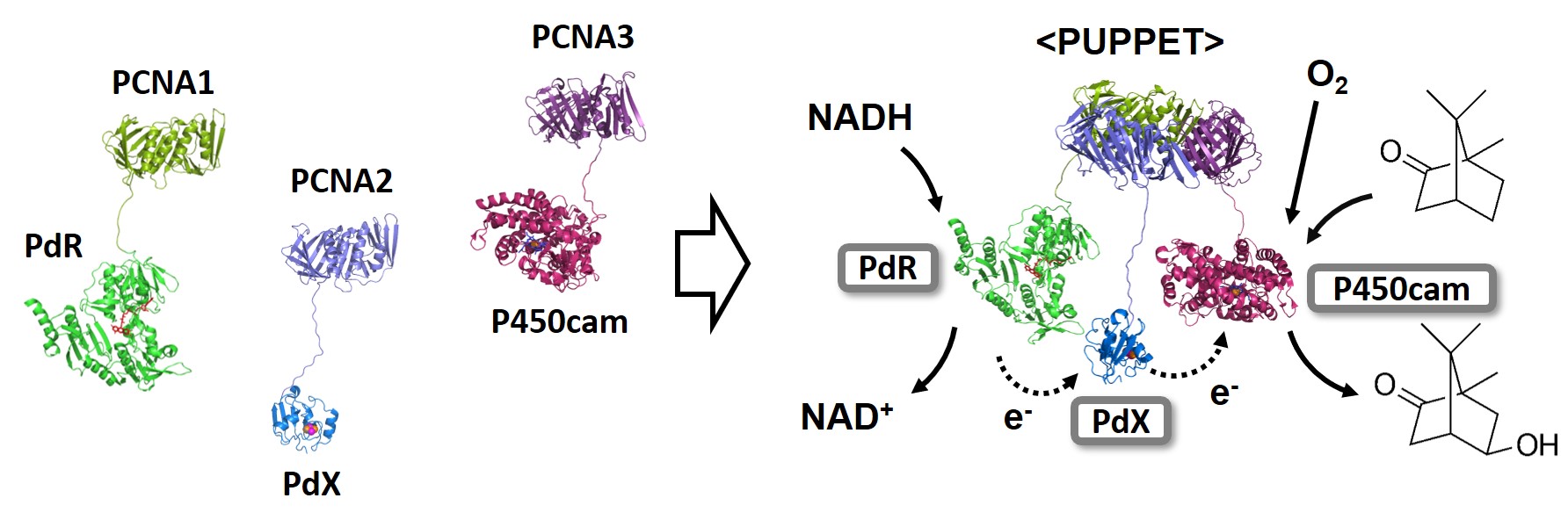
今回の研究では、三量体タンパク質を連結ユニットとして利用することにより、シトクロムP450、電子伝達タンパク質、還元酵素を選択的に集合させ、自己充足型酵素へと変換することに成功しました。
Sulofolobu solfataricus 由来核内増殖抗原(Proliferating Cell Nuclear Antigen, PCNA)は対称的な構造を有するリング状のヘテロ三量体タンパク質です。
このPCNAは3つの異なるサブユニット(PCNA1, PCNA2,
PCNA3)から構成されます。3つのサブユニットはそれぞれ単独での発現が可能であるため、シトクロムP450、電子伝達タンパク質、還元酵素を集合させるための連結ユニットとして利用することができます。実際、PCNAサブユニットと融合したシトクロムP450、電子伝達タンパク質、還元酵素を等モル濃度で混合すると、それぞれを一分子ずつ含むタンパク質集合体のみが得られました。この複合体は分岐型融合P450と同程度の触媒活性を発揮しました。
Bacterial cytochrome P450s catalyze oxidation reactions by accepting electrons from electron transfer proteins which are reduced by their specific reductases. A natural fusion P450 containing an electron transfer domain and a
reductase domain in a single polypeptide chain, P450 BM3 from Bacillus megaterium has inspired artificial fusion of P450 and redox partner proteins. However, genetic fusion of P450 and redox partner
proteins failed to satisfactorily generate self-sufficient P450s. It is worth noting that P450 BM3 is a homodimeric protein and electrons are intermolecularly transferred into the heme domain in the homodimer.
The study on a branched fusion P450 (Protein Eng. Des. Sel., 11, 2010, 1517-1520) suggests that the three components proteins should be attached to single peptide tag, respectively, to generate
self-sufficient P450s. In this study, subunit proteins of a heterotrimeric protein were used as proteinous interlock units to assemble the three proteins.
A proliferating cell nuclear antigen (PCNA) from Sulofolobu solfataricus is a heterotrimeric protein composed of three distinct subunits, PCNA1, PCNA2 and PCNA3. The three subunits can be expressed as
separate proteins, enabling that the subunit proteins can be used as interlock units to assemble P450, electron transfer protein and reductase. Indeed, the three proteins fused to the subunit proteins exclusively formed a heterotrimeric
complex, which shows a high catalytic acitivity.
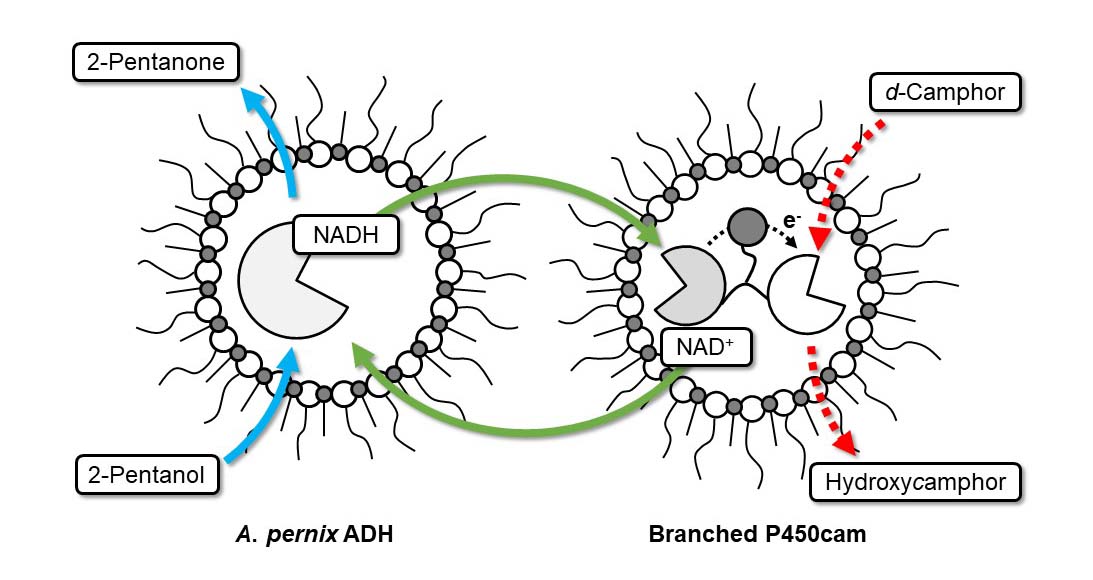
逆ミセル溶液中での好熱性アルコール脱水素酵素と自己充足型P450の共役反応に関する研究です。インパクトのある論文とはなっていませんが、重要な知見を報告しています。
この研究では疎水性基質を扱うために有機溶媒中に微小な水環境が存在する系を利用していますが、有機相中の疎水性基質の濃度を高くしても内水相の基質濃度は飽和濃度よりも低くなります。
考えてみれば当たり前のことですが、疎水性化合物が溶けている少量の水に大量の有機溶媒を添加して抽出したらどうなるかということであり、内水相の疎水性基質の濃度を高くすることは逆に難しくなります。
また、内水相は飽和濃度の有機溶媒を含むことになり、有機溶媒に弱い酵素にとっては不利な環境となります。すなわち、速度論的にも熱力学的にもメリットはありません。基質のほとんどは有機相に分配されるため、反応率の観点からも優れた系とは言えません。
逆に、疎水環境を好み、極性化合物を基質とするAeropyrum pernix 由来アルコール脱水素酵素にとってはメリットの大きな反応系となりました。
実は、Aeropyrum pernix 由来アルコール脱水素酵素は一級アルコールを基質とした場合はsubstrate inhibition、二級アルコールを基質とした場合はsubstrate activationが起こります。
逆ミセル溶液中で炭素鎖の短い二級アルコールを用いた場合、内水相内の濃度は高くなるため、大幅に高い活性を発揮することが明らかとなりました。
Cytochrome P450s are heme-containing monooxygenases that require electron transfer proteins for their catalytic activities. They prefer hydrophobic compounds as substrates and it is, therefore, desirable to perform their reactions in non-aqueous media. Reversed micelles can stably encapsulate proteins in nano-scaled water pools in organic solvents. However, in the reversed micellar system, when multiple proteins are involved in a reaction they can be separated into different micelles and it is then difficult to transfer electrons between proteins. We show here that an artificial self-sufficient cytochrome P450, which is an enzymatically crosslinked fusion protein composed of P450 and electron transfer proteins, showed micelle-size dependent catalytic activity in a reversed micellar system. Furthermore, the presence of thermostable alcohol dehydrogenase promoted the P450-catalyzed reaction due to cofactor regeneration.
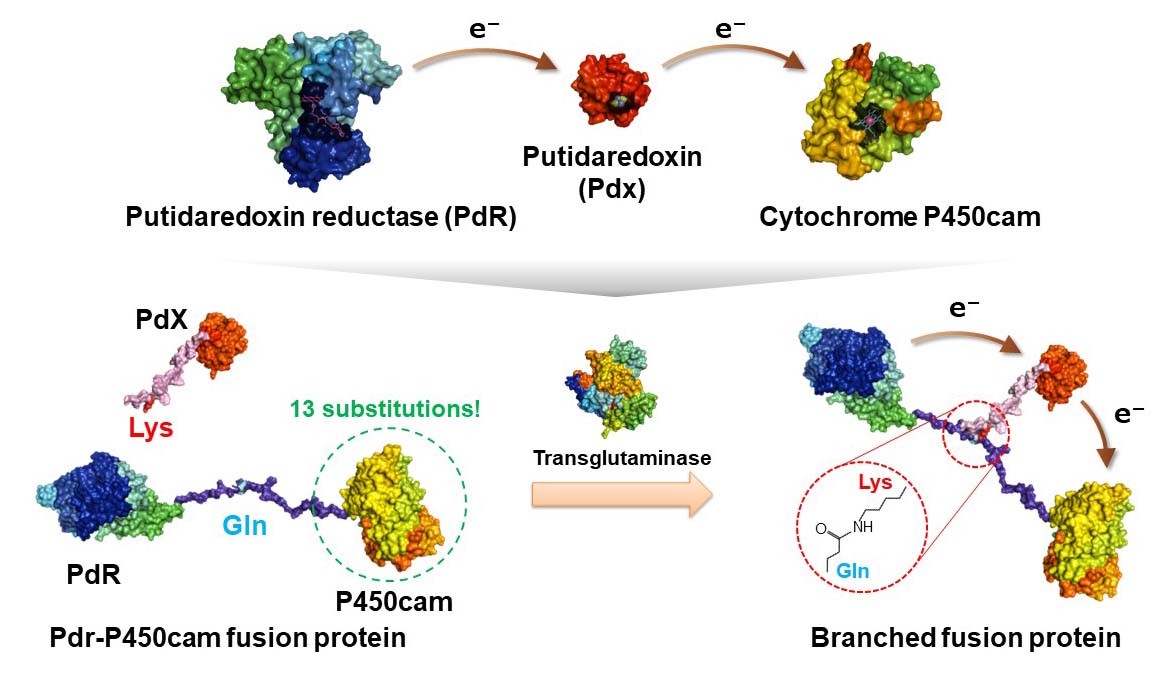
人工的な自己充足型シトクロムP450の構築に成功した実質的に世界初の研究です。水溶性シトクロムP450(class I)は単独では触媒活性を発揮することができず、電子伝達タンパク質(フェレドキシン)とフェレドキシン還元酵素を介して電子の供給を受ける必要があります。
フェレドキシンはシトクロムP450やフェレドキシン還元酵素と弱く相互作用するため、シトクロムP450が十分な触媒活性を発揮するためには、タンパク質としては比較的高濃度な数十µMのフェレドキシンが必要となります。
トランスグルタミナーゼはグルタミン側鎖とリジン側鎖の間におけるペプチド結合形成反応を触媒します。トラスグルタミナーゼの基質となるグルタミン残基を含むペプチド配列でシトクロムP450とフェレドキシン還元酵素を連結して得られる融合タンパク質、同じく基質となるリジン残基を含むペプチド配列を付加したフェレドキシンを用意することで、
トランスグルタミナーゼ反応により分岐型構造を有する融合タンパク質が得られました。この分岐型融合タンパク質ではフェレドキシン還元酵素によるフェレドキシンの還元、フェレドキシンからシトクロムP450への電子伝達が1分子内で起こるため、単独で触媒能を発揮する自己充足型酵素となります。
この研究の10年前に、シトクロムP450、フェレドキシン、フェレドキシン還元酵素を遺伝子上で連結させた直鎖型融合シトクロムP450も報告されていましたが、直鎖型融合シトクロムP450では分子内電子伝達はほとんど起こっていませんでした。
したがって、分岐型融合シトクロムP450は、直鎖型融合シトクロムP450と比べるまでもないほど高い触媒活性を発揮しました。
シトクロムP450を利用するための非常に優れた方法を生み出したわけですが、この研究には一つの大きな欠点がありました。トランスグルタミナーゼの基質認識は比較的緩く、シトクロムP450が有するグルタミン残基およりリジン残基も反応してしまいます。そこで、この研究ではシトクロムP450の表面に位置する計13残基のアミノ酸残基を置換しました。そのため、汎用性には大きな問題がありました。また、この後に行った研究(自発的なヘテロ三量化、ChemBioChem, 11, 2010,
1517-1520)の方が優れていたため、この研究自体が発展することはありませんでした。この当時の技術で13置換を行うことができた(許された?)こと及び13置換をしてもシトクロムP450の触媒活性に大きな変化がなかったことは大きな注目点です。
Cytochrome P450 (P450) is an attractive oxygenase due to the diverse catalytic reactions and the broad substrate specificity. Class I P450s require an excess concentration (more than 10 times) of iron–sulfur proteins, which transfer electrons to P450s, to attain the maximum catalytic activity and this requirement is a critical bottleneck for practical applications. Here, we show a site-specific branched fusion protein of P450 with its electron transfer proteins using enzymatic cross-linking with transglutaminase. A branched fusion protein of P450 from Pseudomonas putida (P450cam), which was composed of one molecule each of P450cam, putidaredoxin (Pdx) and Pdx reductase, showed higher catalytic activity (306 min−1) and coupling efficiency (99%) than the equimolar reconstitution system due to the intramolecular electron transfer. The unique site-specific branched structure simply increased local concentration of proteins without denaturation of each protein. Therefore, enzymatic post-translational protein manipulation can be a powerful alternative to conventional strategies for the creation of multicomponent enzyme systems with novel proteinaceous architecture.
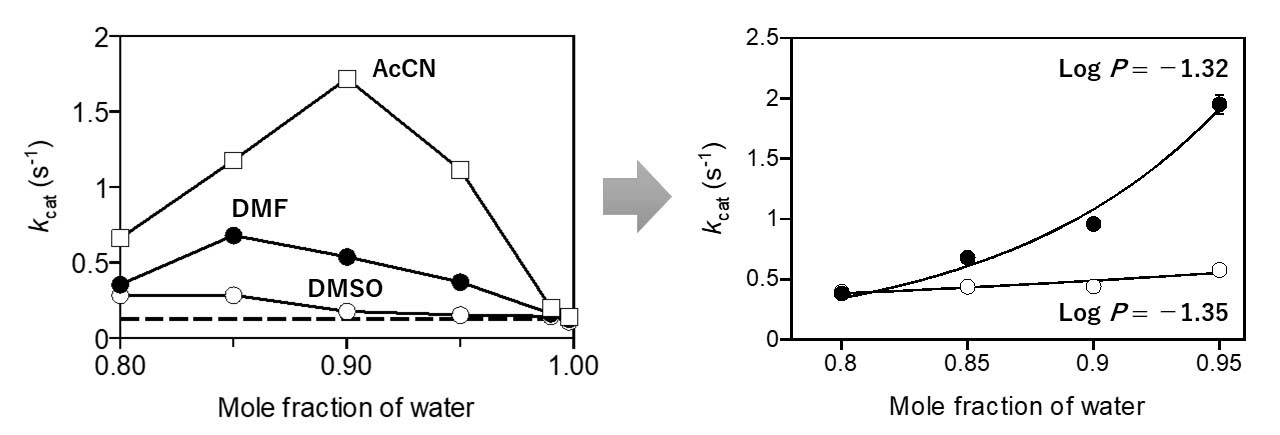
好熱性古細菌Aeropyrum pernix 由来アルコール脱水素酵素の基礎特性については、前報(J. Biosci. Bioeng. 97, 2004, 202-206)で報告しましたが、 それ以外にも興味深いことが分かりました。 Aeropyrum pernix 由来アルコール脱水素酵素は有機溶媒の添加により活性が向上しますが、 活性化の度合は添加する有機溶媒の種類と添加量に依存し、一見、規則性などはありませんで。 しかし、溶媒全体(水+有機溶媒)のlog P 値と有機溶媒の添加量の2つのパラメーターによって、代謝回転数(kcat)は決定されるということを見出しました。 同じ添加量(モル分率)であれば、kcatはlog P 値と直線的な関係で大きくなり、log P 値が同じであれば、添加量に依存して低下する、 つまり、kcatは添加する有機溶媒の化学構造とは無関係であることが明らかとなりました。一方、Kmに関しては、基質の溶解度は有機溶媒との直接的な相互作用の影響を受けるため、 強い相関があるという程度でした。好熱性の酵素は有機溶媒の添加により活性が向上することが経験的には知られていましたが、結局のところ、 どの有機溶媒を添加すればよいかということに対しては明確な答えはありませんでした。しかし、Aeropyrum pernix 由来アルコール脱水素酵素の活性向上に関しては「log P 値の大きい有機溶媒を少量添加すること」が効果的であるとが分かりました。
An alcohol dehydrogenase from the hyperthermophilic archaeon Aeropyrum pernix was activated by water-miscible organic solvents. This activation was influenced by the kind and the concentration of the added organic solvents. The kcat was increased by a factor of over ten when the mole fraction of acetonitrile was 0.1. This effect was large when organic solvents with large log P values were added. In fact, the kcat showed a strong positive correlation with the log P value of the mixed solvent at a constant mole fraction of water, while it was not affected by the kind of organic solvents added. Both the activation enthalpy and the entropy decreased with an increase in log P. The contribution of the activation enthalpy to the free energy of activation was larger than that of the activation entropy, and the free energy of activation decreased with an increase in log P.