研究紹介
私たちの身体は約37兆個の細胞で構成されています。これらの細胞は1つの受精卵が平均で40数回分裂してできたもので、全ての細胞は全く同じ遺伝情報を持っています。そのためには、遺伝情報の担い手である染色体が正確に複製されるとともに、細胞分裂期(M期)においては親細胞から娘細胞に均等に分配される必要があります。この過程に異常が生じると、細胞死やがんをはじめとする様々な疾患につながると考えられております。
我々は、DNA・RNA・タンパク質の巨大複合体であるM期染色体がいかに構築され均等に分配されるかを、分子レベルで明らかにすることを目標としております。
(1) 分裂期染色体の構造と動態制御機構の解明
真核細胞の分裂間期(間期)核内に分散して存在しているクロマチン繊維は、M期に高度に折りたたまれてコンパクトな棒状の構造体(M期染色体)に変換されます。この現象は、一般にM期染色体凝縮とよばれ、長大な染色体DNAを狭い細胞内で均等に分配するために必須です。この過程に異常が生じると、細胞分裂の度に染色体数が変化する染色体不安定性を引き起こします。染色体不安定性はがん細胞の多様性につながり、がんの悪性化の原因となっています(図1)。
我々は、M期染色体がいかに構築され、正確に均等に分配されるかその分子メカニズムの解明に取り組んでおります。そのために我々は、M期染色体の軸である染色体骨格、及び一番外側の周辺領域(PR)に存在するタンパク質とRNAの役割に焦点を絞って研究を行っております。また、それらの機能がタンパク質のリン酸化/脱リン酸化で制御されているかも興味を持っています。
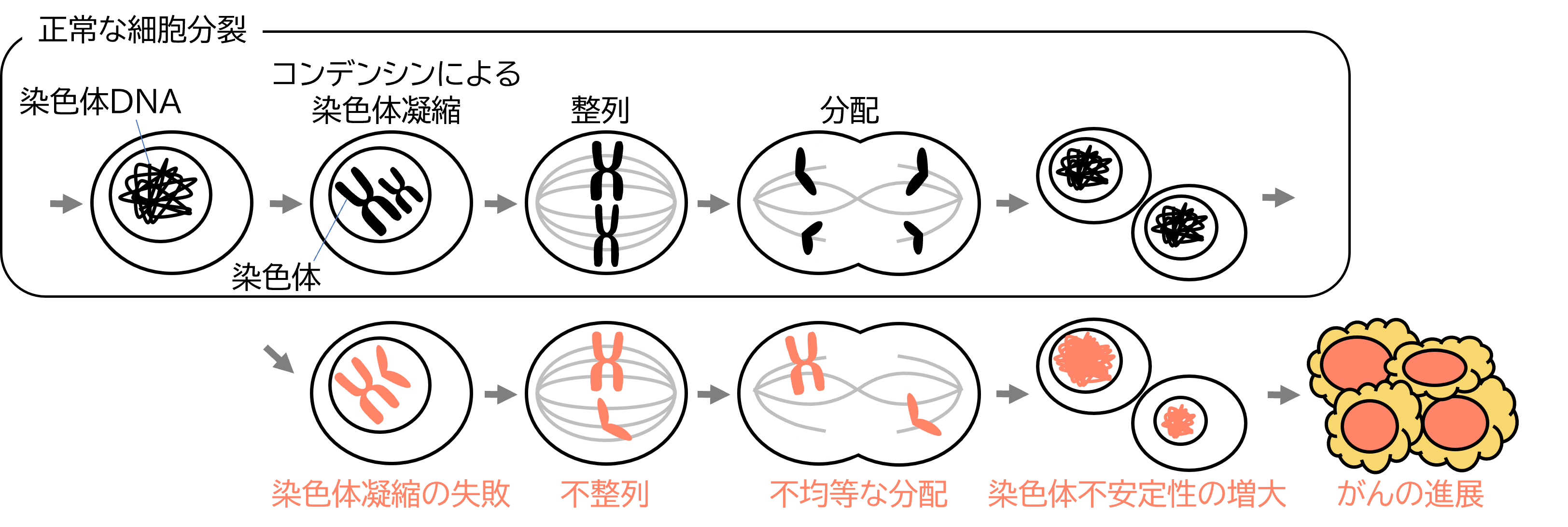
図1 : 細胞分裂と染色体凝縮のメカニズム
(1)-1 染色体に局在するRNAによる染色体骨格タンパク質の制御
M期染色体には、約4,000種類のタンパク質に加えて、1,000種類以上のタンパク質翻訳に関わらないRNA(ノンコーディングRNA)が存在し、重量比においてもM期染色体の約10%を占めていることが報告されています。しかし、M期染色体に局在しているRNAの役割の解明はあまり進んでおりません。
M期染色体に局在するRNAの役割を解析するために、単離したM期染色体からRNase A処理によりRNAを除去したところ、M期染色体の軸が細く脆い構造になることを見出しました。また、RNase
A処理により、コンデンシンI、コンデンシンII、KIF4aといった主要な染色体骨格タンパク質が染色体から解離しました。我々は、いくつかの予備的な実験から、RNAによって促進された液-液相分離が、これらのタンパク質のM期染色体骨格への濃縮に関与するとのモデルを考えております。
液-液相分離とは、溶液が均質に混ざり合わず、2相に分離する現象です。液-液相分離は、膜を持たない構造体の形成、ヘテロクロマチンの形成と転写調節、シグナル伝達など多様な過程に関与することから、近年注目を集めており2018年のScience誌のBreakthrough of the Yearにも選ばれております。現在、液-液相分離を促進するRNAの同定、タンパク質の液-液相分離に関与する部位の特定を目指しています。さらに、それらのRNAを除去、あるいはタンパク質の部位に変異を入れた際に、液-液相分離がM期染色体の構造や動態にどのような影響が生じるかを解明したいと考えます。
(1)-2 プロテインホスファターゼPP2Aとコンデンシンの相互作用の解析
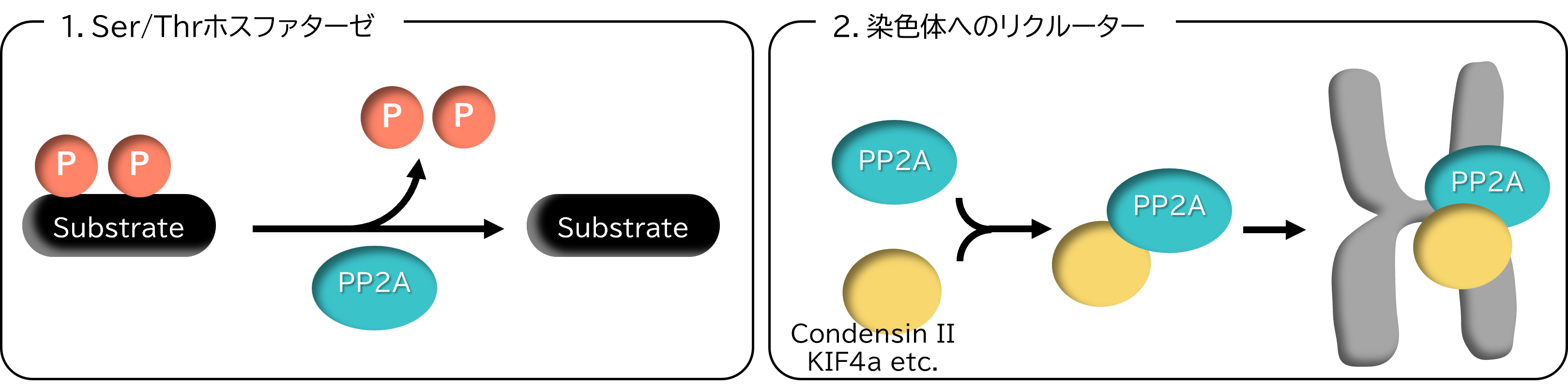
M期の進行は、Cdc2キナーゼをはじめとするM期キナーゼと、PP1, PP2A 等のM期ホスファターゼの絶妙なバランスにより制御されています。PP2Aは、細胞の全タンパク質の1~3%を占める主要なM期ホスファターゼで、複合体形成の足場となるAサブユニット、多様性に富んだ制御Bサブユニット、触媒機能を担うCサブユニットの3つのサブユニットから構成されています。
以前に我々は、PP2Aが脱リン酸化酵素として機能するだけではなく、コンデンシンIIなどのタンパク質と結合して染色体に結合させるリクルーターとしての機能を持っていることを発見しました(Takemoto
et al., Nature Struct. Mol. Biol.,2009, 16, 1302-1308; 図2)。このリクルーターとしての機能は脱リン酸化活性に非依存的な新しい活性です。さらに我々は最近になって、B/B55タイプの制御サブユニットにもつPP2AがコンデンシンIIのCAP-D3サブユニットのC末端側の塩基性アミノ酸のクラスターに特異的に結合することをつきとめました。本プロジェクトでは、培養細胞やツメガエル卵抽出液を用いたシステム、及び生化学的な解析により、PP2AとコンデンシンIIの相互作用が、ホスファターゼの脱リン酸化活性、リクルーター活性にいかに影響を与えるか、ひいてはM期の進行やM期染色体動態の制御にいかなる役割を持つかを明らかにすることを目標にします。
(1)-3 近位依存性(ビオチン)ラベリングによる相互作用因子の探索
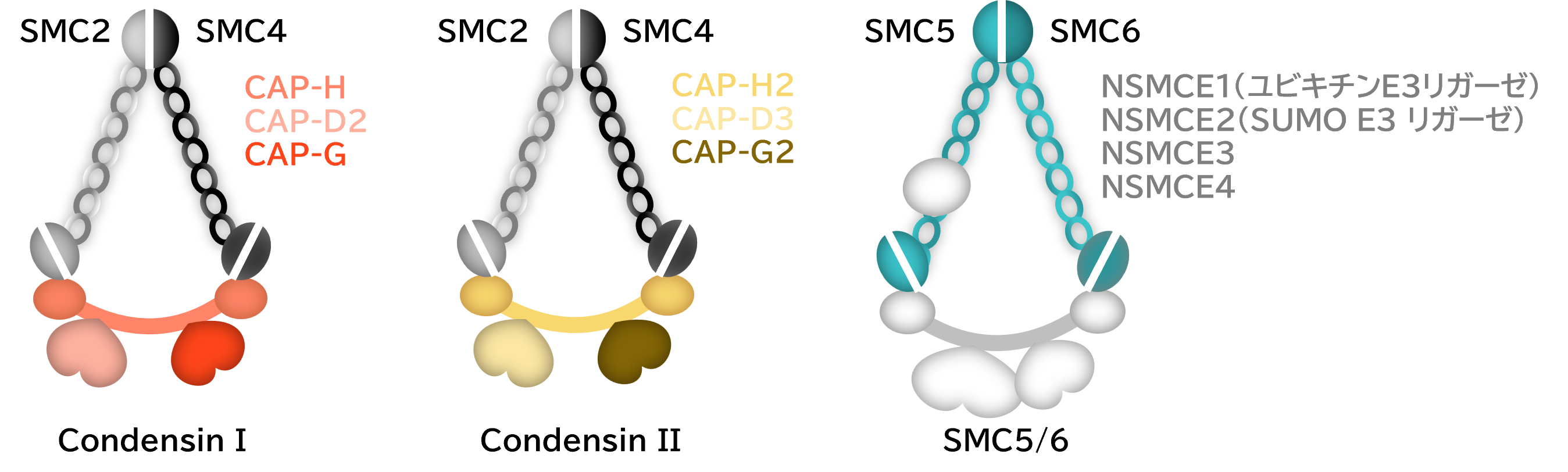
我々は、長年コンデンシンに注目をして研究を進めてきました。コンデンシンは、M期染色体を構成する主要なタンパク質で、M期染色体の凝縮と分配に関与すると考えられております。高等真核生物では、コンデンシンIとコンデンシンIIの2つのタイプが存在しております。M期においては、これら2つのタイプのコンデンシンが独自の機能をもちながらも協調して細胞分裂に機能していると考えられております。一方で、細胞分裂が起こっていない期間(間期)において、コンデンシンIは細胞質に存在するのに対し、コンデンシンIIは核内に存在しており、コンデンシンIIが何らかのクロマチン機能に関与していることが予測されます。コンデンシンIとIIのコアとなるstructural
maintenance of chromosomes (SMC) ATPaseサブユニット(SMC2とSMC4)に関しては共通であるのに対して、3つのnon-SMCサブユニットに関してはユニークです(図3)。従って、2つのタイプのコンデンシンの機能の違いは、non-SMCと相互作用する因子に依存している可能性があります。
また、我々はSMC5/6複合体にも注目しています。SMC5/6複合体は、SMC5とSMC6のヘテロ2量体に加えて、4つのnon-SMCタンパク質から構成されております(図3)。SMC5/6複合体はDNA修復や組換えに機能すると考えられておりますが、他のSMC複合体であるコンデンシンやコヒーシンと比べて解析が進んでおりません。一方で、SMC5/6複合体はnon-SMCサブユニットにSUMO化酵素やユビキチン化酵素を持つユニークな側面を持っており、他のタンパク質を修飾することにより何らかの機能を発揮している可能性があります。
我々の研究室では、近位依存性(ビオチン)ラベリングによりこれらのタンパク質の相互作用因子を探索しています。この方法では、ビオチン化酵素Turbo
IDとの融合タンパク質を細胞内で発現させて近隣に存在するタンパク質をビオチン化し、ストレプトアビジンビーズで回収します。相互作用因子を探索することにより、コンデンシン、SMC5/6複合体の未知の役割が見えてくるかもしれません。
(2) 核小体によるM期染色体ダイナミクスの制御
核小体は真核生物の核内に存在する膜を持たない構造体(核内ボディー)の一つです。古くから、核小体はリボソームRNAの転写とリボソーム生合成の場所として知られています。しかし近年の研究から、核小体はリボソーム生合成に関するタンパク質以外にも多機能のタンパク質から構成されており、核小体がストレス応答・細胞周期の制御・老化・種々の疾患などにも機能することが知られてきています。また、M期では核小体の崩壊に伴い核小体タンパク質や核小体RNAは細胞内に拡散しますが、その一部がM期染色体の周辺部位(PR)に局在することから、核小体とM期との関連が示唆されてきました。
我々は、591種類の核小体タンパク質のスクリーニングにより、M期進行に関わる候補として59種類のタンパク質を同定しました(Hayashi et
al., Science Adv., 2018,4,eaap7777)。さらに顕微鏡観察により、いくつかの核小体タンパク質が正常なM期染色体の形態やダイナミクスに重要な役割を持つことをつきとめました。今後は、個々のタンパク質がどのような分子メカニズムでM期制御に関わるかを詳細に解析する予定です。また、M期進行における核小体RNAの役割にも興味を持って研究を進めています。
(2)-1 SNRNP200によるM期制御の解析
上記のスクリーニングで同定されたタンパク質のうち、現在は細胞分裂に重要な機能を果たすとされるタンパク質SNRNP200に着目した研究を行っています。これまでの実験で、siRNAによってSNRNP200を細胞から枯渇させると、細胞分裂の際に①染色体の接着不全、②紡錘体の多極化が生じることで、分裂の進行が阻害されることを明らかにしています(図4)。さらにこの現象の詳細なメカニズムについて、免疫蛍光染色やPCR、RNA-seqなどの手法を用いて研究を進めています。

図4 : 染色体の接着不全と紡錘体の多極化
(2)-2 MYBBP1AによるM期染色体動態制御の解析
我々の研究室では、Myb-binding protein 1a (MYBBP1A)という核小体タンパク質について研究を行ってきました。MYBBP1Aはがん原遺伝子のc-MYBに結合することにより、その機能を抑制するタンパク質として同定され、がん抑制遺伝子として知られています。我々は、MYBBP1Aがp53タンパク質の活性化による細胞死の誘導に機能することを報告しております。
現在我々は、MYBBP1AがM期染色体の周辺領域(PR)に局在すること、M期の中期から後期への移行を制御する後期促進複合体(APC/C)と相互作用することなどから、MYBBP1AとM期での機能を解析しています。具体的には、国立遺伝学研究所・鐘巻教授により開発されたオーキシンデグロン法によりMYBBP1Aを細胞周期特異的に瞬時に分解して、M期の進行やM期染色体の動態・構造にどのような影響を与えるかを解析しています。